
阿尔茨海默病(AD)是一种进行性神经退行性疾病,尽管在药物干预方面已付出显著努力,但目前可用于治疗AD的有效药物仍十分有限,因此,早期诊断至关重要。随着主观认知能力下降(即阿尔茨海默病的早期临床前阶段),触觉工作记忆功能受损,表现为角度辨别准确度降低和阈值升高,然而,直接证据仍难以证实触觉缺陷是阿尔茨海默病的早期指标及其潜在机制。
在触觉通路中,脊髓后角接收来自背根神经节(DRG)和三叉神经节(TG)假单极初级神经元的传入投射,从而将周围神经系统与中枢神经系统连接起来。尽管在阿尔茨海默病患者的脊髓中也检测到了两种病理标志物—— β -淀粉样蛋白(Aβ)沉积和Tau蛋白负荷,但在9例阿尔茨海默病患者中的3例(约33%)中, Aβ 沉积仅出现在脊髓前角,而Tau相关病理则在大多数阿尔茨海默病患者中遍布整个脊髓。此外,研究显示脊髓中早在Braak 1期(早期阿尔茨海默病阶段)即可检测到磷酸化Tau蛋白(pTau),然而,Tau病理学是否会影响脊髓功能仍不明确。
IF影响因子:25
2025年11月18日,华中科技大学朱铃强小组在《nature neuroscience》上发表了题为“Spinal cord Tau pathology induces tactile deficits and cognitive impairment in Alzheimer’s disease via dysregulation of CCK neurons ”的研究论文。他们的研究发现脊髓Tau病理通过c-Maf依赖的转录重编程驱动 CCK 神经元功能障碍,介导了阿尔茨海默病早期的触觉缺陷,通过特异性沉默脊髓 CCK 神经元中的Tau或c-Maf来干预触觉缺陷,可以有效防止阿尔茨海默病的进展。

引用Signalway Antibody(SAB)七支抗体
Tau(Phospho-Thr231) Antibody,Cat# 11110
Tau(Phospho-Ser262) Antibody,Cat# 11111
Tau(Phospho-Ser396) Antibody,Cat# 11102
Tau(Phospho-Ser404) Antibody,Cat# 11112
Tau(Phospho-Ser214) Antibody,Cat# 11109
Tau(Phospho-Thr181) Antibody,Cat# 11107
Tau(Phospho-Thr217) Antibody,Cat# 11724
Title:
脊髓Tau病理通过 CCK 神经元失调诱导阿尔茨海默病的触觉缺陷和认知障碍。
Abstract:
体感处理已被证实与大脑发育及认知功能相关,但触觉感觉缺陷是否及如何影响认知功能衰退仍不明确。本研究显示,阿尔茨海默病(AD)患者存在触觉功能损害,在症状前3×Tg AD小鼠也观察到了类似的缺陷,同时发现脊髓中CCK神经元对Tau病理学高度敏感。在脊髓CCK 神经元中表达突变型Tau-P301S会异常激活转录因子c-Maf,抑制 CCK 神经元会导致触觉缺陷,而沉默Tau或c-Maf则能恢复触觉并改善阿尔茨海默病模型小鼠的认知功能。这些功能获得与丧失研究表明,脊髓 CCK 神经元中的Tau蛋白病理变化会导致触觉功能障碍和认知功能障碍。针对触觉感觉的干预可能是预测阿尔茨海默病(AD)认知功能障碍进展的有效策略。
Highlights:
1. 阿尔茨海默病早期患者(AD)和小鼠模型对轻触感知受损,但痛觉和运动协调能力正常。
2. 脊髓Tau病理,而非Aβ沉积,是导致阿尔茨海默病早期触觉缺陷的关键因素。
3. Tau病理选择性损害脊髓CCK神经元,导致阿尔茨海默病早期触觉缺陷。
4. c-Maf的异常调节使CCK神经元失活,抑制c-Maf可恢复突触传递与触觉功能。
5. 早期干预脊髓CCK神经元中的Tau病理或c-Maf,可恢复AD触觉并延缓认知衰退。
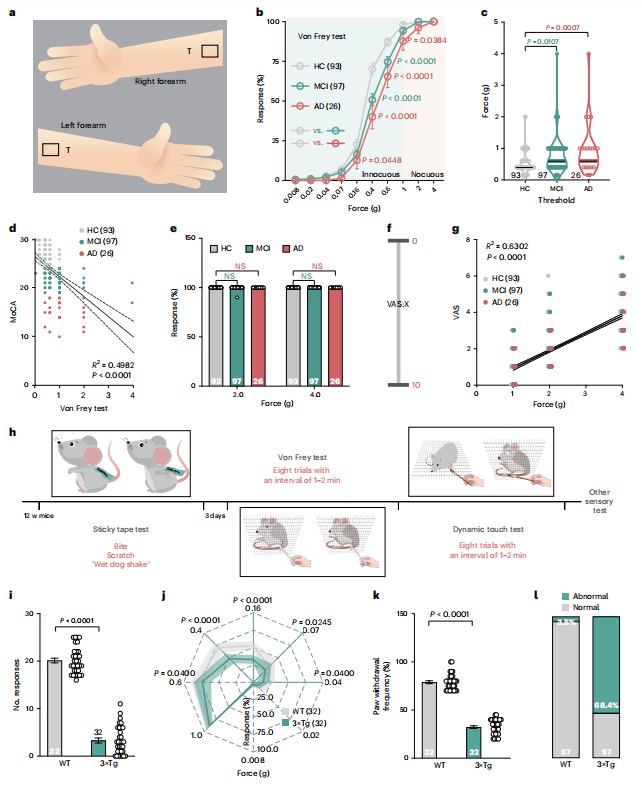
图1 | 早期阿尔茨海默病(AD)患者与模型小鼠的触觉缺陷
【a】前臂感觉测试部位;T,测试区域。
【b】健康对照(HC)、轻度认知障碍(MCI)与AD组对不同力度前臂刺激的反应率。
【c】个体对前臂刺激反应强度。黑色实线表示中位数。
【d】MoCA评分与前臂触觉阈值的相关性。
【e】Von Frey测试中HC、MCI与AD组对2.0或4.0克力度前臂刺激的反应百分比;NS,无显著性差异。
【f】视觉模拟评分(VAS)示意图,0表示无痛,10表示可想象的最剧烈疼痛。
【g】VAS评分与Von Frey测试在1.0、2.0及4.0克刺激下的阈值相关性。
【h】粘性胶带测试实验流程示意图,包含Von Frey测试、动态触觉测试及其他小鼠行为测试。w,周数。
【i】粘性胶带测试。显示3月龄3×Tg与野生型(WT)小鼠的反应次数。
【j】Von Frey测试8-10次试验中3×Tg与WT组的反应百分比。
【k】动态触觉测试。显示3月龄3×Tg与WT小鼠的足部回缩反应百分比。
【l】WT与3×Tg小鼠触觉异常比例(经粘性胶带测试、Von Frey测试及动态触觉测试验证):3.5% vs 68.4%。
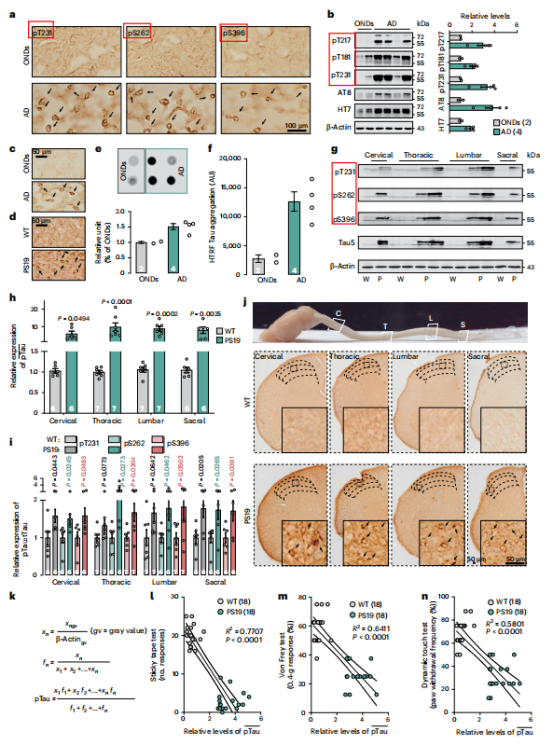
图2 | PS19小鼠脊髓中的Tau病理与触觉缺陷相关
【a】AD或OND患者脊髓后角中高磷酸化Tau(pT231、pS262和pS396)的免疫染色;箭头指示阳性细胞。
【b】OND或AD患者腰段脊髓中pTau的代表性免疫印迹及定量分析。
【c,d】AD或OND患者(c)及PS19与野生型(WT)小鼠(d)腰段脊髓中Tau寡聚体的抗TOC1免疫染色;箭头指示TOC1阳性细胞。
【e】AD患者OND腰段脊髓中Tau寡聚体(TOC1)的代表性点印迹(上)及定量分析(下)。
【f】均质时间分辨荧光Tau聚集实验显示AD中Tau聚集高于OND;AU,任意单位; HTRF ,均质时间分辨荧光。
【g】WT(W)与PS19(P)小鼠颈段、胸段、腰段及骶段脊髓中pTau的代表性免疫印迹。
【h】WT与PS19小鼠脊髓各节段中pTau加权平均水平的定量分析。
【i】WT与PS19小鼠脊髓各节段中pTau与总Tau(tTau)的比值。
【j】PS19与WT小鼠不同脊髓节段后角中pTau(pT231)的免疫组化;箭头指示pT231阳性细胞。A图:完整脊髓标本,分析区段轮廓清晰标注;C:颈段;T:胸段;L:腰段;S:骶段。
【k】算法:pTau蛋白水平加权平均值。
【l-n】图:PS19小鼠与野生型(WT)小鼠在粘性胶带测试(l)、冯·弗莱测试(m)及动态触觉测试(n)中,加权平均pTau水平与行为表现的相关性分析。
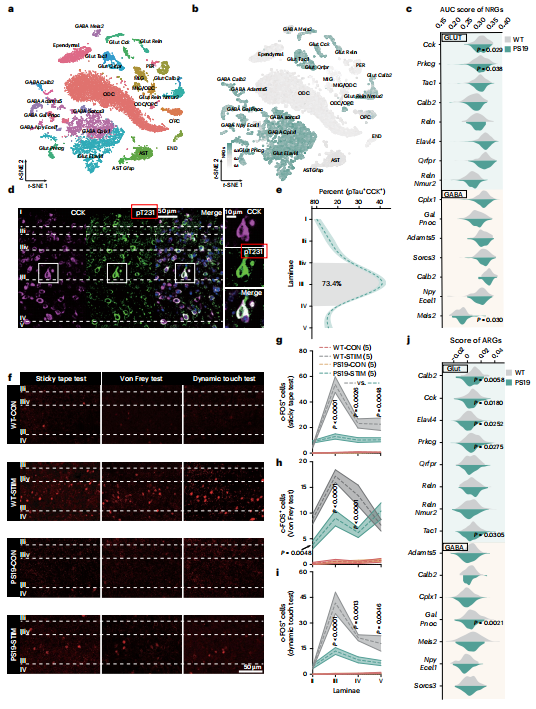
图3 | 阿尔茨海默病中tau病理学使脊髓 CCK 神经元失活
【a】野生型和PS19小鼠脊髓中16,971个细胞核的t-SNE可视化,按细胞类型着色。Glut,谷氨酸能神经元;GABA,γ-氨基丁酸能神经元; ODC ,少突胶质细胞;PER,周细胞;MIG,小胶质细胞;OPC,少突胶质前体细胞;END,内皮细胞;AST,星形胶质细胞。
【b】t-SNE显示所有细胞类型的NRG分数,由AUCell测量。
【c】不同神经元亚型中NRG的平均AUC分数。
【d】PS19小鼠腰段脊髓背侧的代表性免疫荧光图像,用pT231和 CCK 抗体染色, DAPI 复染。右,高倍放大视图。
【e】PS19小鼠背侧脊髓I-V层中pTau+ CCK 中间神经元的百分比量化。阴影区域(IIiv–IV)包含73.4%的pTau+ CCK +神经元。
【F-i】通过c-FOS染色评估PS19小鼠和野生型(WT)小鼠脊髓在无害机械测试前(-CON)与测试后(-STIM)的神经元激活情况。f,代表性图像。
【g–i】粘性胶带测试(g)、冯·弗莱测试(h)及动态触觉测试(i)后不同脑层中c-FOS阳性细胞的定量分析。
【j】不同神经元亚型中ARGs的平均AUC评分。
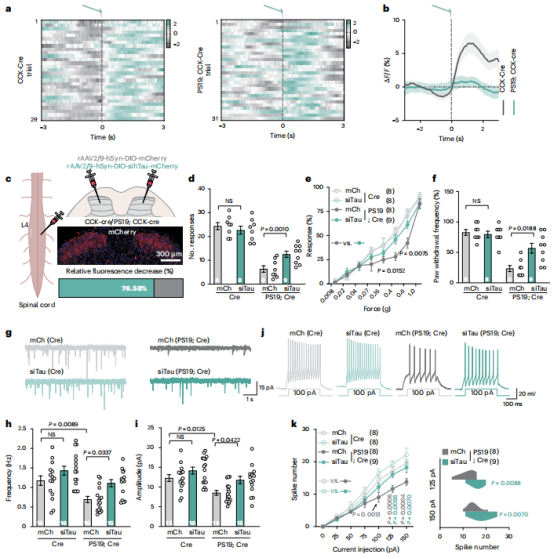
图4 | 在 CCK 神经元中沉默Tau蛋白可恢复阿尔茨海默病(AD)的触觉
【a,b】脊髓神经元中的平均 Ca2+ 反应 (CCK::jGCaMP8s) 与 CCK-Cre (a) 和 PS19 中的冯弗雷丝刺激一致; CCK-Cre 小鼠 (b);箭头表示刺激开始。
【c】左图,示意图显示将siTau或其对照病毒(mCh)注射到PS19的脊髓后角; CCK-Cre (PS19; Cre) 和 CCK-Cre (Cre) 小鼠。右中,mCherry 荧光分布;右下角,后角 hTau 荧光相对减少。
【d-f】按c 处理的小鼠的行为反应。显示了胶带测试中的响应数量(d)、Von Frey 测试中的响应百分比(e)以及动态触摸测试中的缩爪响应百分比(f)。
【g】按照c中处理的小鼠脊髓中的第IIIi-IV层的CCK神经元记录的sEPSC的代表性痕迹。
【h,i】g 中记录的 sEPSC 频率 (h) 和幅度 (i) 的量化。
【j】脊髓中第 IIi-IV 层 CCK 神经元响应 c 中处理的小鼠去极化电流步骤的代表性动作电位。
【k】左,发射率与去极化电流。右,j 中发射率的差异。
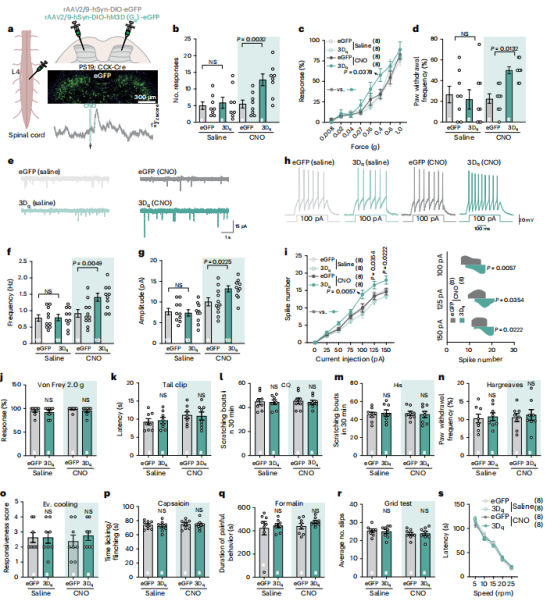
图5 | CCK 神经元的化学遗传学激活可逆转 AD 小鼠的触觉损伤
【a】左图及右上图,示意图显示将rAAV2/9-hSynDIO-hM3D(Gq)-eGFP(3Dq)与对照病毒(eGFP)注射至PS19; Cre小鼠后角的情况。右中图, GFP 荧光分布。右下图, CCK 神经元对单次雷酸盐注射(100 µM)的jGCaMP8s Ca2+信号代表性记录。
【b–d】hM3D感染的PS19; Cre小鼠在雷酸盐或溶剂(生理盐水)处理下的行为反应。显示了粘贴测试中的反应次数(b)、冯·弗莱测试中的反应百分比(c)以及动态触觉测试中的爪子回缩反应百分比(d)。
【e–g】背角IIi–IV层 CCK 神经元的代表性sEPSC轨迹(e)及频率(f)与振幅(g)的定量分析。
【h】脊髓IIi–IV层 CCK 神经元对去极化电流阶跃的代表性动作电位。
【i】左图:放电率与去极化电流的关系;右图:放电率差异。
【j–s】hM3D感染的PS19; Cre小鼠对急性机械性疼痛(j和k)、急性化学性瘙痒(l和m)、热性和化学性疼痛(n和q)及运动协调(r和s)的反应,其中使用雷酸盐或溶剂对照;CQ,氯喹;His,组胺;Ev.,蒸发。
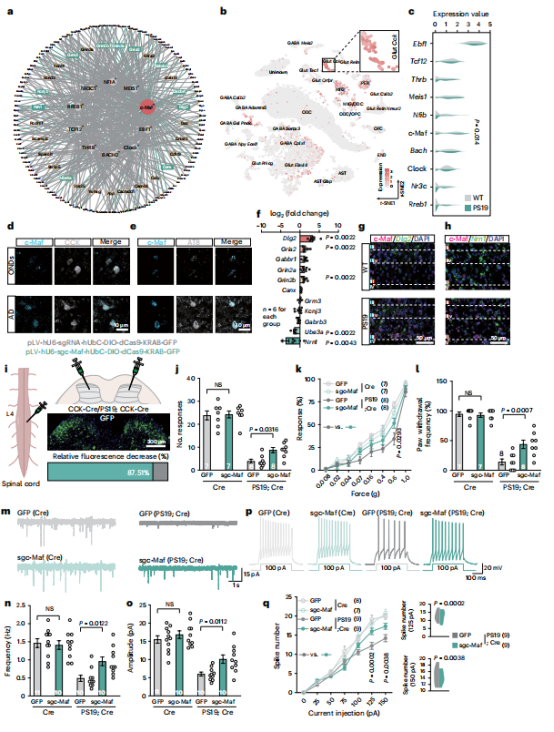
图6 | CCK 神经元中的c-Maf调控子介导Tau病理诱导的触觉缺陷
【a】谷氨酸能 CCK 神经元与NRGs中差异表达基因相关前十调控子的调控网络;灰色表示转录因子;黄色表示靶基因;绿色表示c-Maf靶基因;外圈表示差异表达基因中的NRGs。
【b】不同细胞类型中c-Maf表达的t-SNE可视化图;谷氨酸能 CCK 簇被高亮显示。
【c】谷氨酸能 CCK 神经元中前十调控子的小提琴图。
【d,e】OND 和AD样本后角神经元中c-Maf与 CCK (d)或AT8(e)共定位的代表性图像。
【f】野生型(WT)和PS19小鼠腰段脊髓中c-Maf靶基因的相对mRNA水平。
【g,h】野生型和PS19小鼠后角神经元中c-Maf与Dlg2(g)及Nrn1(h)共定位的代表性图像。
【i】PS19小鼠、Cre小鼠及Cre小鼠脊髓后角注射pLV-hU6-sgc-Maf-hUbC-DIO-dCas9- KRAB - GFP(sgc-Maf)和对照病毒(GFP)的示意图。右中图: GFP 荧光分布。右下图:后角c-Maf荧光相对减少情况。
【j–l】触觉测试反应(包括粘性胶带测试j、Von Frey测试l和动态触觉测试l),实验对象为i组处理的小鼠。
【m】i组处理小鼠脊髓IIi–IV层 CCK 神经元记录的sEPSC典型轨迹。
【n,o】m图记录的sEPSC频率(n)和振幅(o)量化结果。
【p】i组处理小鼠脊髓IIi–IV层 CCK 神经元对去极化电流阶跃的典型动作电位反应。
【q】左图:放电频率与去极化电流的关系。右图:p图中放电频率的差异。
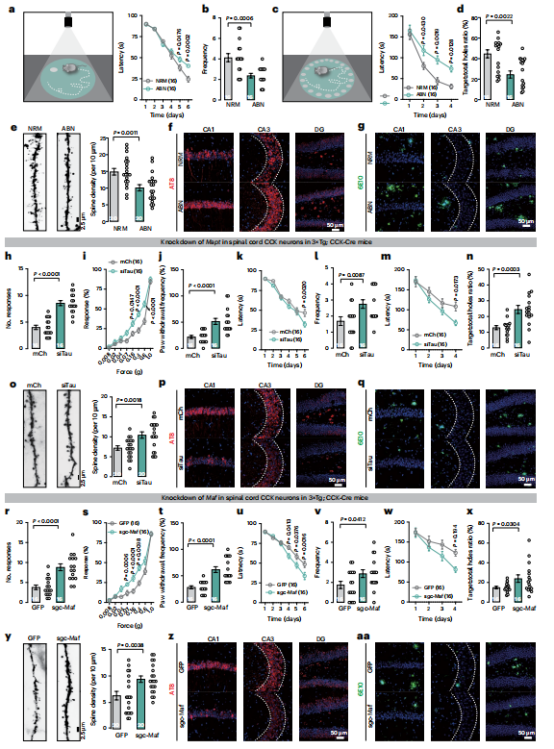
图7 | 在 CCK 神经元中沉默Tau或c-Maf可延缓阿尔茨海默病(AD)的进展
【a,b】Morris水迷宫实验。测定 NRM 和ABN小鼠在训练期间(a)及第8天(b)对隐藏平台的逃逸潜伏期。
【b,d】Barnes迷宫实验。测定 NRM 和ABN小鼠在训练期间(c)及第5天(d)对目标孔的逃逸潜伏期及准确率。
【e】NRM 和ABN小鼠海马树突棘的高尔基染色(左)及定量分析(右)。
【f,g】NRM 和ABN小鼠CA1、CA3及齿状回(DG)中pTau(AT8;f)和 Aβ(6E10;g)的免疫荧光检测。 DAPI 用于细胞核染色。
【h–j】mCh和siTau小鼠在触觉测试中的反应,包括粘性胶带测试(h)、Von Frey测试(i)和动态触觉测试(j)。
【k–q】Morris水迷宫(k和l)及Barnes迷宫(m和n)分析同a–d,高尔基染色(o)同e,免疫荧光(p和q)同f和g(另一组mCh和siTau小鼠)。
【r–t】GFP 和sgc-Maf小鼠在触觉测试中的反应,包括粘性胶带测试(r)、Von Frey测试(s)和动态触觉测试(t)。
【u–aa】Morris水迷宫(u和v)及Barnes迷宫(w和x)分析同a–d,高尔基染色(y)同e,免疫荧光(z和aa)同f和g(另一组 GFP 和sgc-Maf小鼠)。
Conclusion:
综上所述,Tau蛋白病理改变会破坏脊髓 CCK 神经元中的c-Maf转录调控网络,导致神经元功能失活和触觉功能障碍。本研究共同揭示了Tau蛋白病理在脊髓中的分子机制,以及这种病理如何在AD小鼠早期阶段引发触觉缺陷。该团队的发现阐明了Tau蛋白病理在触觉功能障碍中的作用,并为未来开发AD的无创生物标志物和治疗靶点奠定了基础。


