前言
细胞周期是一个受到严格调控的基本过程,它确保真核细胞的有序分裂与增殖,对维持基因组稳定性至关重要。该周期包含G1期(间隙1)、S期(合成期)、G2期(间隙2)和M期(有丝分裂期)四个连续阶段,其正常运行由一系列关键的检查点精密控制。然而,当这些检查点失调,导致细胞增殖失控时,便成为癌症的一个核心标志,这通常与肿瘤抑制基因和原癌基因的缺陷密切相关。近年来,对细胞周期调控分子机制,尤其是各关键检查点控制通路的深入理解,为开发针对癌症的潜在治疗靶点提供了新的见解。
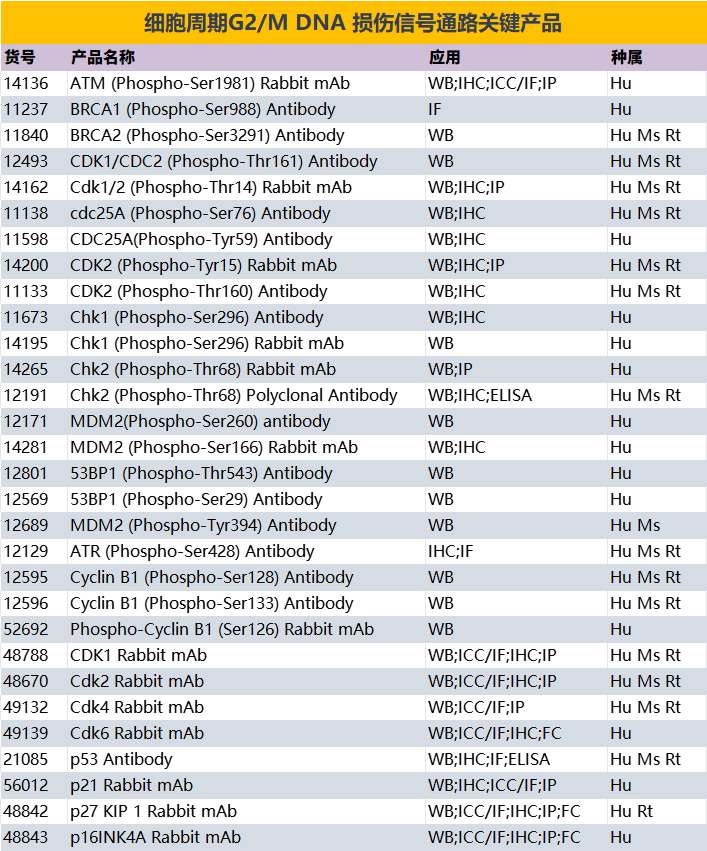
【一】细胞周期关键检查点及其调控机制
细胞周期检查点起着监视机制的作用,确保细胞在未满足所有正常分裂条件的情况下不会进入下一阶段。这些检查点由细胞周期依赖性激酶 (CDK)、细胞周期蛋白(cyclins)、肿瘤抑制因子和检查点蛋白组成的网络调控。值得注意的是,关键检查点存在于 G1/S 转换期、G2/M 转换期以及有丝分裂期间。
G1/S 检查点
G1/S检查点是细胞周期调控的关键点之一。它确保细胞做好DNA复制的准备,并检查生长因子等外部信号。细胞周期蛋白cyclin D-CDK4/6复合物通过磷酸化视网膜母细胞瘤蛋白(Rb)来促进G1期的进展。磷酸化的Rb会释放E2F转录因子,从而激活DNA复制所需基因的表达。
肿瘤抑制因子p53是该检查点的另一个关键参与者。它可以通过上调p21 (CDK 活性抑制剂)来诱导 DNA 损伤引起的细胞周期停滞或凋亡。此外, INK4 家族(包括 p16 INK4a)和Cip/Kip 家族(包括 p21 和 p27)作为 CDK 活性的负调控因子,确保细胞不会过早进入 S 期。
DNA损伤反应(DDR)通路在调控G1/S检查点中的作用。例如, ATM/ATR激酶被DNA损伤激活,并通过磷酸化p53和其他下游效应蛋白来抑制CDK活性,从而导致细胞周期停滞。
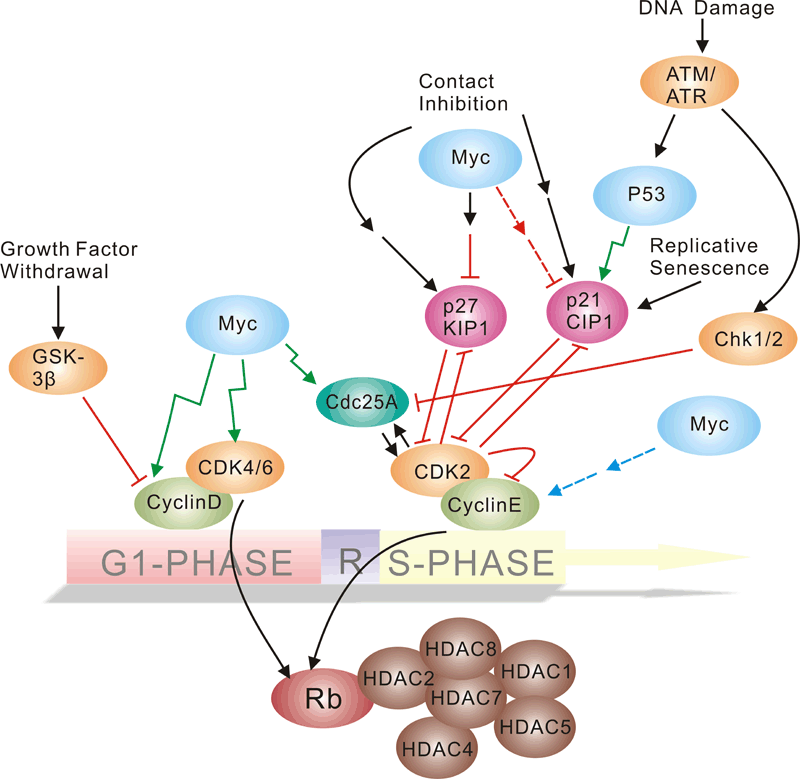 From: Signalway Antibody
From: Signalway Antibody
G2/M 检查点
G2/M检查点在有丝分裂开始前监测DNA的完整性。细胞周期蛋白cyclin B-CDK1复合物对于启动从G2期到M期的转变至关重要。DNA损伤会导致CHK1和CHK2激酶被激活,CDC25磷酸酶磷酸化,从而抑制CDK1的激活。
p53是调控G2/M检查点的关键因子,它诱导GADD45和其他参与DNA修复或促进细胞凋亡的基因表达。此外, ATM/ATR信号通路作为CHK1/CHK2的上游激活因子发挥作用,确保在存在DNA损伤的情况下不会发生G2/M转换。
最近的研究表明,aurora激酶(尤其是aurora A和B )在G2/M期调控中也发挥着重要作用,它们参与染色体的排列和纺锤体的形成。aurora激酶失调在癌细胞中很常见,这使得癌细胞成为治疗干预的热门靶点。
纺锤体装配检查点(SAC)
纺锤体组装检查点 (SAC)是一个关键的保障机制,它确保染色体在有丝分裂后期开始前在纺锤体上正确排列。SAC 由一个复杂的网络调控,该网络涉及Mad2、Bub1、BubR1和Mps1等蛋白质。这些蛋白质会阻止后期促进复合体/环体(APC/C)的激活,直到染色体正确排列 。
SAC的异常调控可导致染色体不稳定,这是许多癌症的标志。最近的研究表明,靶向 SAC蛋白(例如BubR1 )可以增强某些化疗的疗效。
【二】癌症中的细胞周期调控
由于关键抑癌基因和致癌基因的突变,癌细胞常常表现出细胞周期调控异常。超过50%的癌症患者会观察到p53抑癌基因功能丧失,导致细胞周期检查点缺陷,从而允许受损DNA增殖。同样,细胞周期蛋白cyclin D1或CDK4的扩增会导致G1/S检查点的组成性激活,从而促进细胞增殖失控。
抑制剂(CKIs),例如p21和p27,在癌细胞中经常下调,导致细胞周期进程不受抑制。此外,视网膜母细胞瘤(Rb)通路的改变,包括Rb突变或Rb家族蛋白的功能丧失,可使细胞绕过G1/S检查点。
【三】细胞周期调控在癌症治疗中的意义
了解控制细胞周期的分子机制为开发癌症靶向疗法提供了方向。CDK抑制剂,例如palbociclib和ribociclib,已在临床试验中展现出良好的前景,尤其是在治疗激素受体阳性乳腺癌方面。这些药物选择性靶向细胞周期蛋白cyclin D1-CDK4/6复合物,从而恢复肿瘤细胞的正常细胞周期调控。
01 激酶抑制与曾敏
CHK1等检查点激酶抑制剂,可以提高癌细胞对化疗和放疗等DNA损伤药物的敏感性。靶向aurora激酶是另一种新兴策略,像alisertib,正在血液系统恶性肿瘤的临床试验中进行测试。
02 校正周期缺陷
检查点抑制剂(例如p53再激活剂和CDK抑制剂)正在被开发,以逆转癌细胞中出现的细胞周期缺陷并瞄准和消除肿瘤细胞的能力。
03 靶向周期蛋白
细胞周期蛋白cyclin A和B在细胞周期的调控中也起着关键作用,其能通过与特定的底物蛋白如E2F1相互作用来调节细胞的增殖和分裂。最新的研究开发了一种新型的细胞周期蛋白A/B RxL抑制剂,不仅具有良好的细胞渗透性和口服生物利用度,而且在多种小细胞肺癌细胞系和动物模型中表现出显著的抗肿瘤活性,这一发现有望为小细胞肺癌等难治性癌症的治疗提供新的思路和潜在的治疗策略。
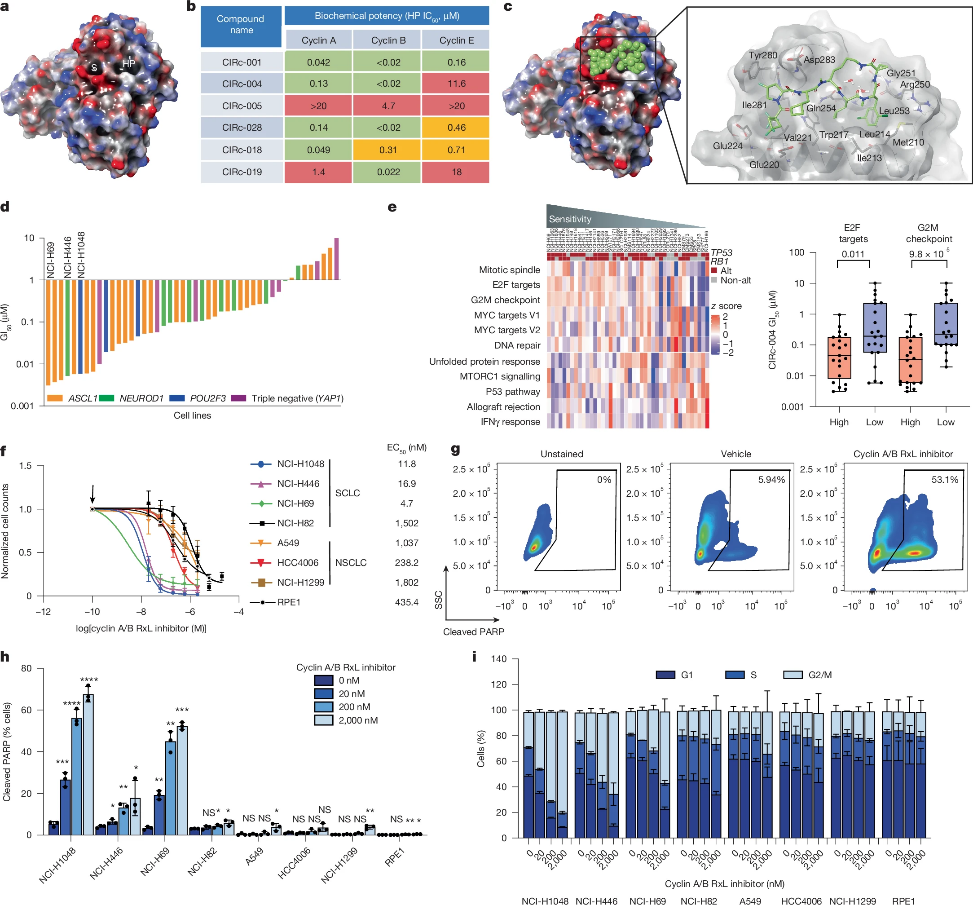
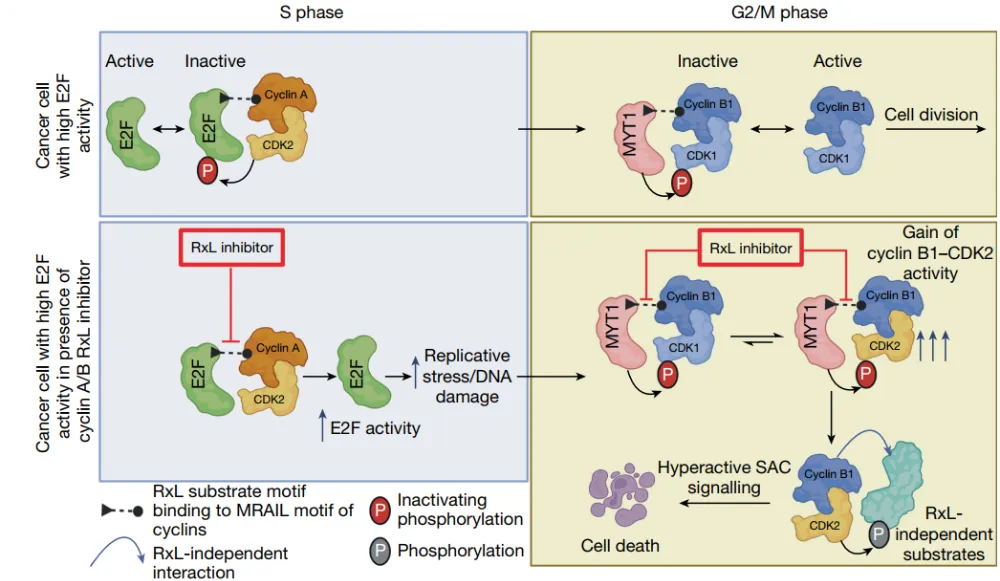 From: Singh, S.et al. Targeting G1–S-checkpoint-compromised cancers with cyclin A/B RxL inhibitors. Nature (2025). doi:10.1038/s41586-025-09433-w
From: Singh, S.et al. Targeting G1–S-checkpoint-compromised cancers with cyclin A/B RxL inhibitors. Nature (2025). doi:10.1038/s41586-025-09433-w
结语
细胞周期调控是一个复杂且高度协调的过程,受众多检查点通路调控。这些调控机制的紊乱会显著促进癌症的发生发展。对调控这些检查点的分子机制和信号通路的理解不断深入,促进了靶向癌症疗法的发展。目前对细胞周期调控分子基础的研究有望为癌症治疗的新策略提供更深入的见解。
References
▶ Singh, S., Gleason, C.E., Fang, M. et al. Targeting G1–S-checkpoint-compromised cancers with cyclin A/B RxL inhibitors. Nature (2025). doi:10.1038/s41586-025-09433-w
▶ Sherr, C. J., & Roberts, J. M. (1999). CDK inhibitors: Positive and negative regulators of G1-phase progression. Genes & Development, 13(12), 1501-1512.
▶ Vousden, K. H., & Lane, D. P. (2007). p53 in health and disease. Nature Reviews Molecular Cell Biology, 8(4), 275-283.
▶ Malumbres, M., & Barbacid, M. (2009). Cell cycle kinases in cancer. Nature Reviews Cancer, 9(3), 153-166.
▶ Zhou, B. B., & Elledge, S. J. (2000). The DNA damage response: Putting checkpoints in perspective. Nature, 408(6811), 433-439.
▶ Bartek, J., & Lukas, J. (2003). Chk1 and Chk2 kinases in checkpoint control and cancer. Cancer Cell, 3(5), 421-429.
▶ Ciccia, A., & Elledge, S. J. (2010). The DNA damage response: Making it safe to play with knives. Molecular Cell, 40(2), 179-204.
▶ Ditchfield, C., Johnson, V. L., Tighe, A., Ellston, R., & Tugendreich, S. (2003). Aurora kinase inhibitors provide insights into how to target mitosis. Nature Chemical Biology, 4(6), 347-353.
▶ Musacchio, A., & Salmon, E. D. (2007). The spindle-assembly checkpoint in space and time. Nature Reviews Molecular Cell Biology, 8(5), 379-393.
▶ Fu, X., et al. (2016). Targeting the spindle assembly checkpoint in cancer. Nature Reviews Cancer, 16(3), 179-193
▶ Harris, C. C. (1996). p53 tumor suppressor gene: From the basic research laboratory to the clinic—an abridged historical perspective. Carcinogenesis, 17(8), 1187-1198.
▶ Lukas, J., et al. (1994). Cyclin D1 activation and human malignancy. Nature, 366(6450), 295-296.
▶ Waga, S., & Hannon, G. J. (1994). The p21 inhibitor of cyclin-dependent kinases is a cyclin D binding protein. Nature, 366(6450), 274-276.
▶ Finn, R. S., et al. (2015). Palbociclib and letrozole in advanced breast cancer. The New England Journal of Medicine, 373(21), 1996-2005.
▶ Kumagai, A., et al. (2010). Inhibition of checkpoint kinase 1 (Chk1) enhances the cytotoxic effects of DNA-damaging agents. Cancer Research, 70(1), 429-436.
▶ Levine, R. L., et al. (2017). Aurora kinase inhibitors in hematologic malignancies: A new frontier. Blood, 130(13), 1483-1491.
▶ Vassilev, L. T., et al. (2004). Small-molecule antagonists of p53-MDM2 binding: Concept and development. Molecular Cancer Therapeutics, 3(9), 1021-1032.


